
中文
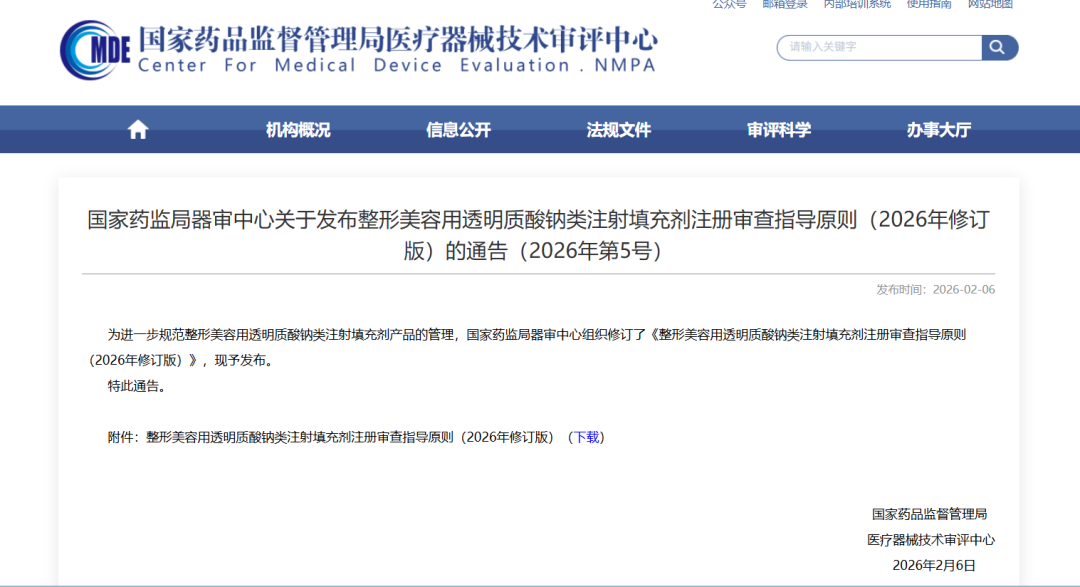
政策速递[烟花] 器审中心发布《整形美容用透明质酸钠类注射填充剂注册审查指导原则(2026年修订版)》[玫瑰]
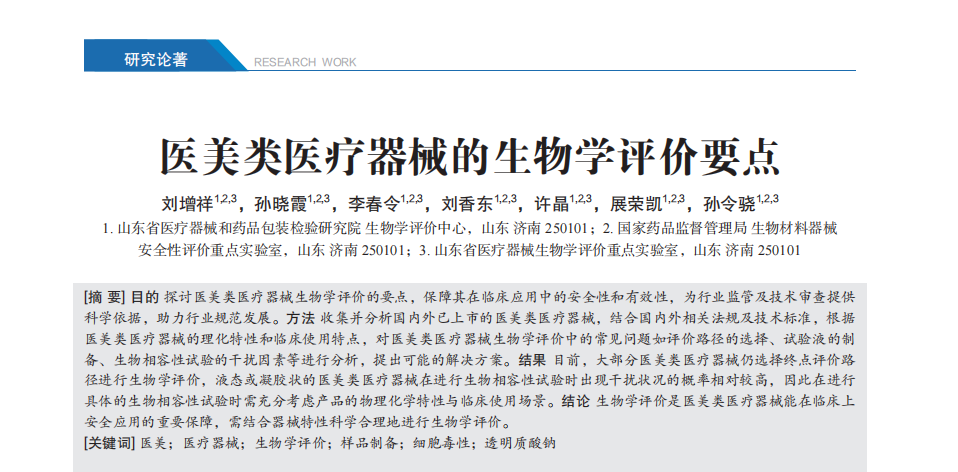
医美市场迅猛发展,医美类医疗器械安全性备受关注。 本文深入探讨医美器械生物学评价要点,从产品分类、风险等级到评价路径、试验液制备及常见问题全面解析,旨在为行业提供科学评价指导,保障消费者安全,推动医美行业规范、健康发展。

CMDE医美共性问题答疑(2017-2025年)汇总
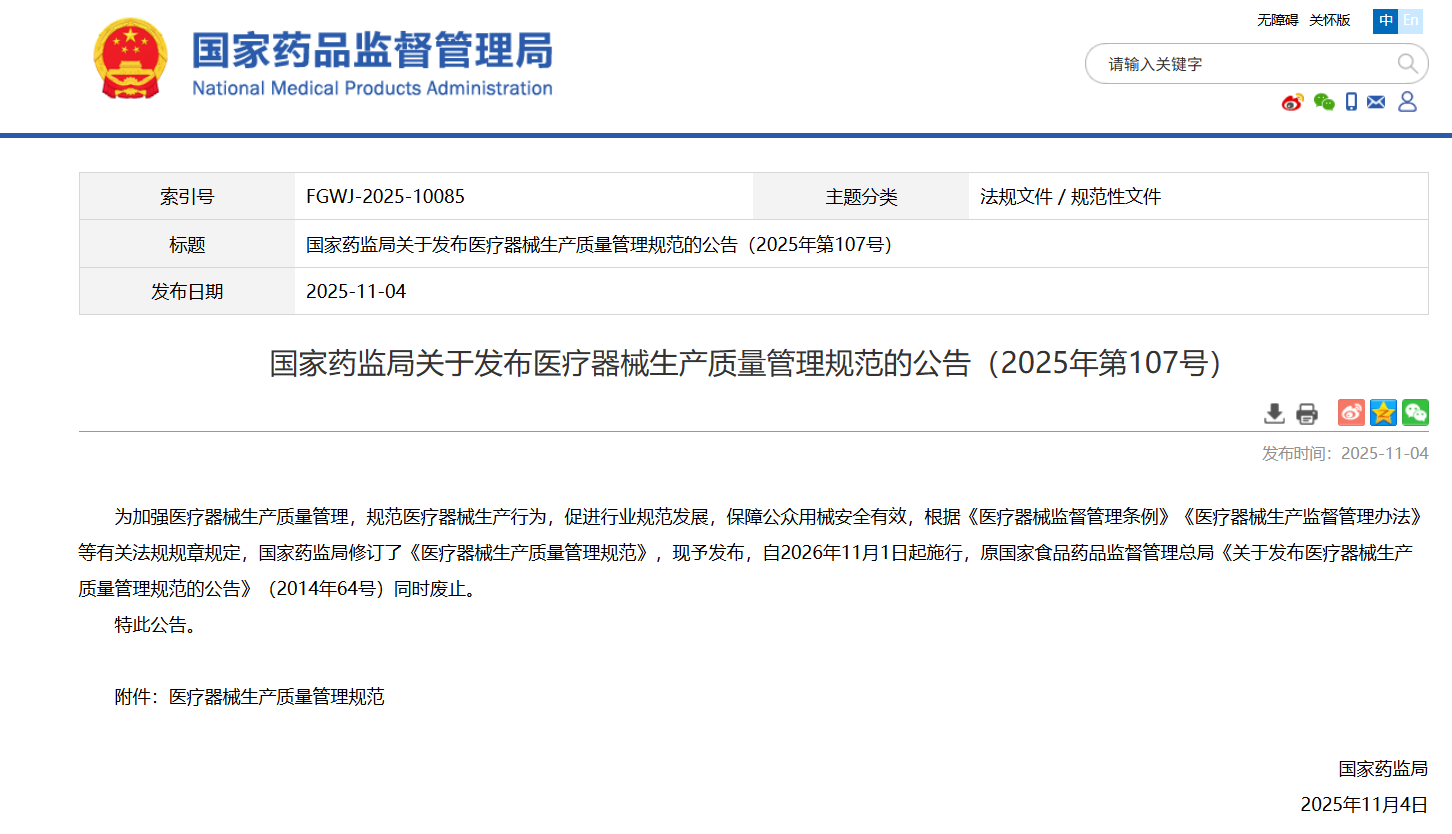
政策速递[玫瑰]核查中心发布《医疗器械生产质量管理规范》修订对照表
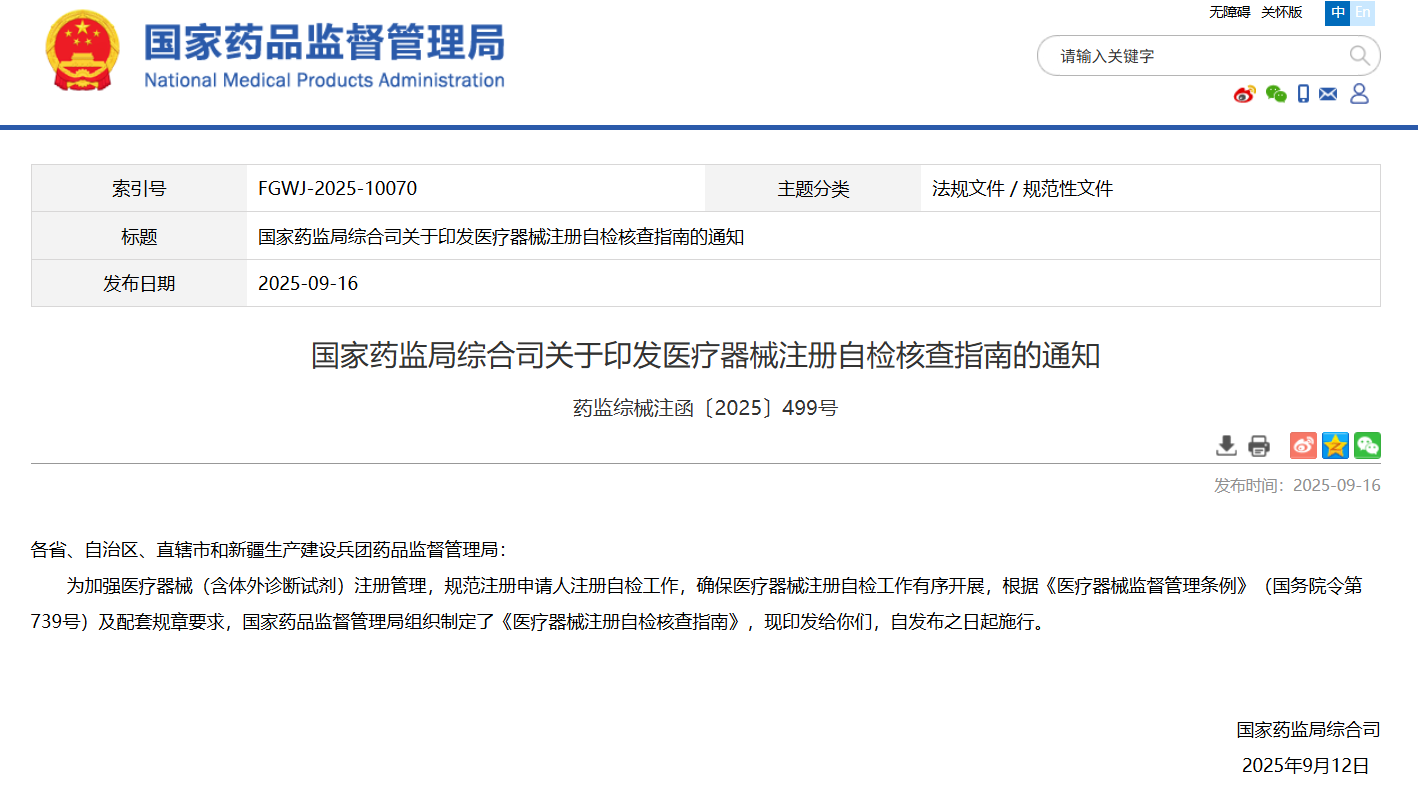
9月16日,为加强医疗器械(含体外诊断试剂)注册管理,规范注册申请人注册自检工作,确保医疗器械注册自检工作有序开展,根据《医疗器械监督管理条例》(国务院令第739号)及配套规章要求,国家药品监督管理局组织制定了《医疗器械注册自检核查指南》,自发布之日起施行。
国家药监局器审中心组织制定了《藻酸盐敷料注册审查指导原则》,现于2025年8月21日发布。
Copyright ?2020 苏州苏豪生物材料科技有限公司 版权所有
苏ICP备19075400号-1 ![]() 苏公网安备32050602011157号 互联网药品信息服务资格证编号:(苏)-非经营性-2020-0041
苏公网安备32050602011157号 互联网药品信息服务资格证编号:(苏)-非经营性-2020-0041