
羟基磷灰石(HA),这一化学结构为 Ca₁₀(PO₄)₆(OH)₂ 的生物陶瓷材料,因其与人体骨骼和牙齿中的矿物质高度相似的成分,以及出色的生物相容性与骨传导性,最初在骨科手术中大展拳脚,作为骨填充材料助力骨愈合。随着技术的日新月异,羟基磷灰石已成功跨界医美领域,成为皮肤填充剂和牙科修复的新宠。此跨界之举不仅为医美行业注入了新活力,也吸引了众多投资者的瞩目。然而,随着其广泛应用,临床风险与政策监管的挑战也接踵而至。本文将对羟基磷灰石在医美领域的应用现状、产品解析、市场规模、政策监管及未来发展进行深入探讨。
一、“羟基磷灰石”到底是何方神圣?
羟基磷灰石(Hydroxyapatite, HAp)是一种无机矿物,其化学式为 Ca₅(PO₄)₃(OH),主要由钙、磷和氢氧化物组成,还含有少量的镁、锌、铁等微量元素。约占骨骼重量的 70% 和牙釉质的 90%。其晶体结构为六方晶系或单斜晶系。
羟基磷灰石作为一款再生性材料,是构成人体骨骼的主要成分,其不含免疫原,具有良好的生物活性和生物相容性。置入体内后不会发生炎性和异物反应,不易引起炎症、过敏等安全性问题,与此同时,它还具备可降解性、可再生性、持久塑形性。正是基于以上特性使得羟基磷灰石在医美行业中熠熠生辉,成为了备受瞩目的再生材料。在医美实际应用中,羟基磷灰石通常以 25-45 微米的微球形式存在,大大减少了注射过程中的皮肤创伤和严重副作用的风险。

二、临床应用:从骨科到美学的跨界突破
在骨科领域,羟基磷灰石被广泛应用于骨缺损的修复、骨折的愈合以及人工关节的植入等手术中。其优越的生物相容性使得患者在接受治疗后能够较快恢复,且极少出现排异反应。此外,羟基磷灰石的骨传导性促进了新骨形成,助力骨愈合过程的顺利进行。
近年来,随着材料制备工艺的提升,羟基磷灰石逐步跨界进入医美领域,主要用于骨缺损填充和软组织注射填充。其特有的粒径工艺使其具备刺激胶原再生、收紧提升的功效,且可被人体安全代谢,对比传统的胶原和玻尿酸填充剂,效果持续周期更长。在医美领域,主要应用于以下方面:
面部填充:注射用填充剂常用于隆鼻、丰颏、填充法令纹或凹陷性瘢痕,效果自然且维持时间较长(通常 1-2 年以上)。
皮肤年轻化:通过刺激胶原增生,改善皮肤质地。
新兴领域:颈部、手部、身体皮肤松弛改善。
1. 作用机制:即刻支撑与长效再生的完美协同
良好的生物相容性:羟基磷灰石与人体骨结构接近,具有较低的炎性刺激。在植入人体后,它能够与周围组织良好地融合,减少排斥反应的发生,不易过敏,安全性高。
持久的填充效果:相较于透明质酸填充物(通常 6-12 个月效果),羟基磷灰石的维持时间可达 18 个月以上,部分研究甚至显示其刺激胶原的长期作用可能延长效果。
刺激胶原再生:能够刺激 I 型和 III 型胶原蛋白的新生,弹性蛋白以及蛋白聚糖的再生,进而发挥抗衰老、紧致皮肤和面部塑形等功效,增强皮肤质量。
稳定的物理性质:其多孔微球结构为细胞提供粘附位点,促进细胞增殖,有利于细胞外基质的分泌和沉积。
2. 对比传统填充剂:效果更胜一筹
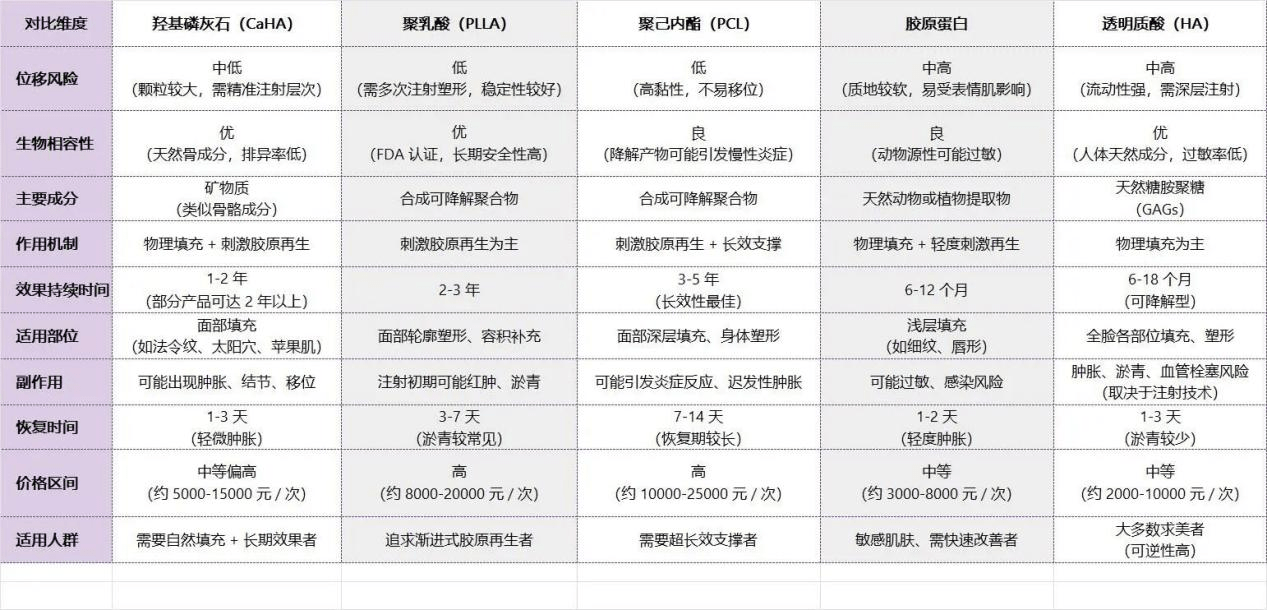
来源:远见 CVC
三、产品与技术分析
1. 已上市羟基磷灰石产品
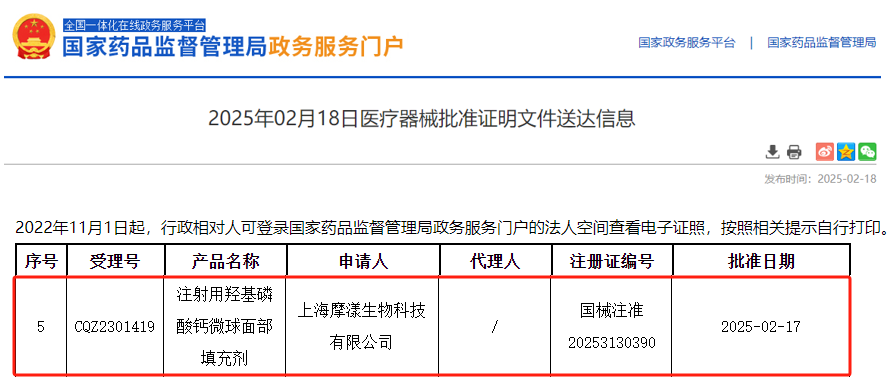
据统计,目前国内获批上市的以羟基磷灰石为主要成分的产品有 51 种,本表列出了所有已上市的产品,其中第 1~49 项适用于骨科和口腔,而目前面部产品仅有第 50 和第 51 项,即 上海摩漾生物科技有限公司-注射用羟基磷酸钙微球面部填充剂(国械注准 20253130390)和梅尔茨北美公司 Merz North America Inc.-注射用羟基磷酸钙微球面部填充剂 RADIESSE INJECTABLE IMPLANT(国械注准 20253130390)。

来源:药监局数据
从这个表格可以看出,那些已经开展骨科和口腔业务的机构,也是医美新材料的潜在竞争方,或合作伙伴。
2. 医美领域主要产品与技术特点
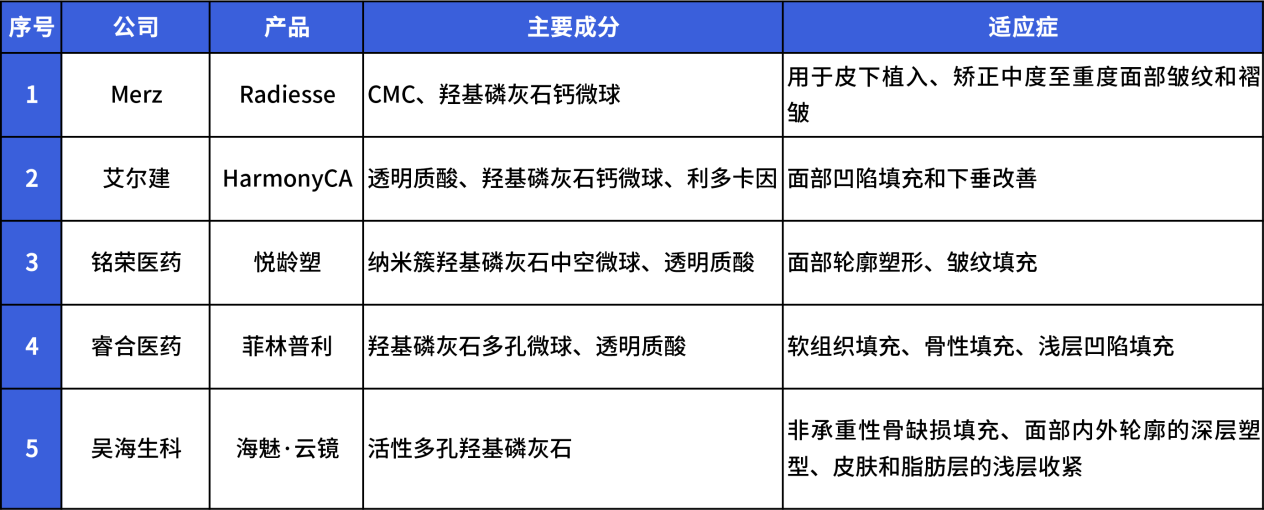
针对医美领域的羟基磷灰石填充产品全球范围内获批使用的仅有 4 款,其中含中国获批 1 家。在此之前,国内医美市场上几乎所有用于面部填充的羟基磷灰石产品,都依赖骨科或牙科适应症“打擦边球”进入市场。其中主要原因之一就是新适应症的临床试验和审批周期较长,一些企业选择绕过合规路径,使产品快速进入市场。
(1)Radiesse(Merz Pharma):
• 描述:由 30% 羟基磷灰石钙(CaHA)微晶球体与 70% 羧甲基纤维素钠凝胶(CMC)构成,由微球悬浮在水性羧甲基纤维素凝胶载体中。注射后,CMC 凝胶即时填补容积,3-6 个月后凝胶载体被巨噬细胞清除,留下 CaHA 微球作为支架,刺激新胶原蛋白生成,提供即时和长期的体积填充。
• 用途:用于矫正鼻唇沟、木偶纹等中度至重度面部皱纹,以及手部体积增强。效果持续时间:约 18 个月。
• 审批:Radiesse 于 2006 年获 FDA 批准,用于面部皱纹矫正和手部体积增强。当前唯一一款经 FDA 批准的羟基磷灰石医美注射剂。已于 2025 年 3 月 7 日获 NMPA 批准上市,国械注进 20253130124。
(2)HARmonyCa (Allergan):
• 描述:HARmonyCa 是一种混合填充物,结合了 CaHA(55.5%)和交联透明质酸(44.5%),提供双重效果:透明质酸提供即时提升,CaHA 刺激长期胶原生成。临床研究显示,其胶原效果可持续 12 个月,整体改善可持续 1-3 年。
• 用途:用于中脸和下脸的体积增强和提升,特别适合需要自然提升和长期效果的患者。
• 效果持续时间:1-3 年。
• 审批:目前获得欧盟 CE 认证,进入以色列、巴西以及部分欧盟国家市场。未在美国获 FDA 批准。2024 年 9 月宣布,已在中国完成注册检验,即将展开临床试验。早先在 2024 年 2 月,已经在中国香港地区上市。
(3)FACETEM(CGBio):
• 描述:由韩国 CGBio 公司生产,是一种用于面部轮廓塑造的羟基磷灰石填充剂。粒径采用梯度设计(15-75μm),悬浮于羧甲基纤维素钠凝胶基质中。微球表面通过等离子喷涂技术修饰,结晶度达 92%,接近天然骨矿物相。临床研究显示,其在注射后 6 个月时胶原密度提升至基线 2.8 倍,效果可持续 18 个月。
• 用途:用于中重度鼻唇沟矫正(Ⅲ期临床试验显示 12 个月体积保持率 83%)、下颌轮廓塑形(CT 影像显示骨性支撑改善率 75.6%)、颧弓重建(孔隙梯度支架设计,骨整合时间缩短至 6 周)。
• 效果持续时间:1-2 年
• 审批:2023 年获韩国 MFDS 批准(KFDA 23-3456),为首款多适应症 CaHA 产品。2024 年通过欧盟 CE 认证(MDD 93/42/EEC),适应症扩展至颈部年轻化。
(4)Aphranel®优法兰(上海摩漾生物):
• 描述:主要成分为羟基磷酸钙、羧甲基纤维素钠、甘油、注射用水,粒径范围 25-45μm,悬浮于羧甲基纤维素钠凝胶基质中,辅以甘油和注射用水。微球采用中空介孔结构(BET 比表面积≥210m²/g),表面通过专利技术修饰,结晶度达 92%,接近天然骨矿物相。皮下层注射,12 个月体积保持率 82%。
• 用途:用于鼻唇沟部位皮下层注射,以纠正中重度鼻唇沟皱纹。
• 审批:2025 年 2 月 17 日,摩漾生物注射用羟基磷酸钙微球面部填充剂获批(国械注准 20253130390),是国内首款用于面部填充的羟基磷灰石产品。
四、市场格局
1.全球市场:欧美主导,亚洲崛起
2023 年全球羟基磷灰石钙 (CaHA) 填充剂市场规模为 6.481 亿美元,预计在预测期内的复合年增长率 (CAGR) 为 13.8%。在皮肤填充剂市场中,羟基磷灰石占比 7%,仅次于玻尿酸(77%),高于 PLLA(6%)。2023 年,美国占据了北美市场的最大份额。根据国际美容整形外科协会 (ISAPS) 的报告,2022 年,美国进行了近 4,556,970 例非手术注射手术。
2. 中国市场:爆发前夜,合规先行
2023 年,中国占据亚太地区最大的市场份额,2024 年中国市场规模预计超 50 亿元,年复合增长率 16%,预计在预测期内将成为增长最快的地区。
2025 年 2 月,国内首张合规证落地,上海摩漾生物首获面部填充适应症(2025 年获批),标志行业进入规范化阶段。预估首张合规证企业有望占据 50% 以上市场份额,摩漾生物或成最大受益者。
来源:药监局
国内多家企业如昊海生科(海魅云境)、金赛药业等积极布局,跨界玩家丸美生物通过参股摩漾生物间接参与竞争,实现“曲线救国”,享受合规红利。
五、核心驱动因素
1. 人口老龄化:根据美国整形外科医师协会的报告,美国近 50.2% 的 CaHA 填充手术都是针对 55 至 69 岁人群进行的。该年龄段人群的主导地位归因于老年人面部脂肪和体积的损失。CaHA 填充剂可增加因衰老而失去脂肪和胶原蛋白的区域的体积,恢复年轻和紧致的外观。2022 年全球进行了近 350,716 例 CaHA 填充剂手术。
2. 技术创新突破:微球结构优化(如 25-45μm 粒径)Merz 推出了 Radiesse + Lidocaine 用于下颌轮廓塑造。引入麻醉药物利多卡因,可确保患者在填充剂使用过程中更加舒适。复合技术(如 CaHA+透明质酸):HA/CaHA 双相体系延长效果持续时间 40%。同时纳米级羟基磷灰石拓展应用场景,如化妆品、营养剂等。
3. 医美渗透率提升:发展中国家美容标准变化、经济可及性提高,对“自然美”和“长效美”需求提升,促进轻医美需求,推动再生材料市场增长。
六、监管环境与政策影响
1. 国内外监管差异
(1)美国:FDA 严格审批,上市后监控体系完善。
在美国,食品药品监督管理局(FDA)将含羟基磷灰石的填充物归类为医疗设备,需通过严格的临床试验获得批准。
监管趋势包括:
上市前审批:要求提供控制临床研究数据,评估安全性和有效性。
上市后监控:FDA 通过被动监控系统(如 MedWatch)收集不良事件报告,持续评估产品安全性。
新兴趋势:随着纳米技术和新配方的开发,监管机构可能加强对羟基磷灰石相关产品的安全性评估,特别是纳米级材料的潜在风险。
(2)中国:2024 年新规要求 III 类医疗器械单独申报,严查超适应症使用。
我国对医用羟基磷灰石实行Ⅲ类医疗器械管理,但分类编码体系存在交叉。骨科产品(13-05 类)与医美填充剂(13-09 类)的审批要求差异显著:前者豁免临床试验,后者需完成至少 500 例随机对照试验。这种制度漏洞导致部分企业通过"非承重骨缺损"适应证曲线进入医美市场,形成监管灰色地带。
2020 年 9 月 30 日,国家药监局医疗器械标管管理中心发布的《2020 年第二批医疗器械产品分类界定结果汇总》中将羟基磷灰石微球的医疗美容产品归类为 III 类医疗器械进行管理,分类编码为 13-09。深圳等地试点"适应证合规检查",对超范围使用机构实施最高 20 万元行政处罚,2024 年查处违规案例同比增加 320%。
2. 合规化趋势
一些企业和机构正在积极推进羟基磷灰石在面部填充领域的合规化进程,如开展多中心、单盲、随机对照等临床研究,以期获得监管部门的批准。同时,监管部门也将加强对医美机构和从业人员的管理,规范羟基磷灰石的使用和推广。
七、挑战与展望:从合规到创新,重塑医美生态
1. 主要挑战
技术壁垒与安全性争议:
HA 填充剂的颗粒大小、分散均匀性及降解速度需精准控制,技术门槛较高。
偶发炎症反应(如肉芽肿)可能影响消费者信心,需长期临床数据验证。
市场竞争激烈:
传统材料(玻尿酸、胶原蛋白)占据主导地位,消费者教育成本高。
新型再生材料(如 PLLA、PCL)抢占抗衰市场。
监管复杂性:
市场乱象:非合规产品滥用、伪劣产品流通。
截至 2025 年初,多数 HAP 产品仍处于“超适应症使用”状态,获批范围仅限骨科、牙科,医美应用尚未完全合法化。深圳市等地方监管机构已要求医美机构自查,但消费者认知滞后,社交平台仍充斥未合规产品宣传。且各国医疗器械审批标准差异大(如 FDA、CE、NMPA),延长产品上市周期。
2. 技术演进方向
材料改性增强性能:
复合化:与胶原蛋白、透明质酸结合,提升柔韧性和即时填充效果。
纳米化:纳米级 HA 颗粒提高生物活性,促进皮肤再生。
功能化:添加抗菌成分(如银离子)或抗氧化剂(如维生素 E),减少并发症。
•精准递送与可控降解:
开发可注射凝胶或微球载体,实现 HA 的靶向释放与降解速率调节。
3D 打印技术定制个性化骨修复支架或面部填充方案。
智能化与数字化结合:
AI 影像分析优化注射点位设计,提升疗效与安全性。
3. 潜在机会
新兴市场渗透:
印度、巴西等中高收入群体扩大,政策放宽推动 HA 产品准入。
医美旅游(如韩国、泰国)带动跨境消费。
• 再生医学结合:
HA 联合干细胞疗法或生长因子(如 EGF),开发“修复+再生”一体化方案。
生物活性支架在创伤修复、瘢痕治疗中的潜力。
• 差异化定位:
针对男性抗衰市场(如下颌线塑形),开发专用配方。
轻医美场景延伸(如微针联合 HA 透皮递送)。
个性化定制:3D 打印技术结合患者解剖结构。
全生命周期管理:术后跟踪与效果优化。
结语
随着医美行业的兴起,羟基磷灰石作为医美再生材料的“明日之星”,其临床应用已从骨科、牙科向医美领域深度渗透。羟基磷灰石市场的快速发展也引来了政策监管的关注,建立完善的监管体系和行业标准将是提升羟基磷灰石市场整体水平和消费者信心的关键。企业创新,行业规范,政策监管,实现“合规化是起点,创新是终点”,羟基磷灰石有望成为轻医美领域的“骨相美学”新标杆。
参考资料:
1. 《从骨科到医美:羟基磷灰石行业研究|行研》
2. 《从骨科到医美:羟基磷灰石如何成为抗衰新宠?》
3. 国家药监局数据等
奥泰康苏州 CDMO 中心
中心了承担“国家十三五重点研发计划生物材料研发与组织器官修复替代”专项课题,实现“低免疫原性胶原,丝素蛋白工程化制备技术及其产品研发”科技成果转化,建立丝素蛋白(SFM)核心技术平台,并进一步储备透明质酸、PLA、PLLA、葡聚糖、PCL、多肽、聚乙烯、PVA、聚氨酯、聚四氟乙烯、微晶钙、壳聚糖、羟基磷灰石、人源化胶原蛋白等多种新一代主流医用材料研发技术。
公司能够提供组织修复及器官再造整体解决方案,为生产型和销售型企业提供技术升级和新项目储备服务,现与国内外多家药品及医疗器械企业建立战略合作关系。
Copyright ?2020 苏州苏豪生物材料科技有限公司 版权所有
苏ICP备19075400号-1 ![]() 苏公网安备32050602011157号 互联网药品信息服务资格证编号:(苏)-非经营性-2020-0041
苏公网安备32050602011157号 互联网药品信息服务资格证编号:(苏)-非经营性-2020-0041