-
【2020】
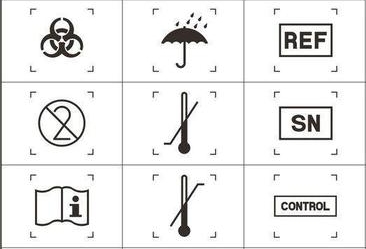
【07-01 】医疗器械常见符号标识大全医疗器械标签是指在医疗器械或者其包装上附有的用于识别产品特征和标明安全警示等信息的文字说明及图形、符号。 在法规中规定的标签主要指贴附于机身的标签,但由于某些产品本体无法贴附标签,只能通过在包装上注明标识,.. 来源
来源  3328
3328 -

【2020】
【06-10 】 -
【2020】
【06-05 】总局印发《医疗器械生产质量管理规范独立软件现场检查指导原则》《医疗器械生产质量管理规范独立软件》链接:/keditor/attached/file/20200605/20200605180140_16238.doc 来源
来源  860
860 -

【2020】
【06-09 】苏豪再次成功签约CDMO项目5月18日,苏豪再次成功签订CDMO单子:一次性射频消融电极产品研发注册项目。该项目的成功签约为后续公司的CDMO业务打下良好基础! 来源 苏州苏豪生物材料科技有限公司
来源 苏州苏豪生物材料科技有限公司 1271
1271 -

【2019】
【12-25 】生物制药领域最具价值新药研发项目TOP10全球知名生命科学行业市场咨询公司Evaluate旗下EP Vantage近日发布报告,对生物制药领域最有价值的TOP10新药研发项目进行了分析,以下是每个药物的简答介绍。 1、Tirzepatide 该药是.. 来源
来源  1115
1115 -

【2019】
【12-25 】医药制药使命制药人的使命:保障药品安全、有效、均一、稳定。 第一,社会公共性。人类的生物秉赋一直在促使人类尽可能的增进健康、延长生命以保证人类的繁衍。药品因其特殊功效而倍受重视。在现代社会,享有健康的权利和生命的权利已经成为受法律保护.. 来源
来源  1090
1090 -

【2019】
【12-25 】重磅!《人类遗传资源管理条例》签发,不出境的临床试验人类遗传资源改为备案制了!摘录:“为获得相关药品和医疗器械在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,不需要审批。但是,合作双方在开展临床试验前应当将拟使用的人类遗传资源种类、数量及其用途向国务院.. 来源
来源  1244
1244 -

【2019】
【12-25 】【创新医疗器械】审查政策12月起巨变!快来看看你家产品是否符合新的申报要求?新修订的《创新医疗器械特别审查程序》完善了适用情形、细化了申请流程、提升了创新审查的实效性、完善了审查方式和通知形式,并明确对创新医疗器械的许可事项变更优先办理。修订的《创新医疗器械特别审查程序》,程序设置更为科学有效,有利.. 来源
来源  1079
1079 -

【2019】
【12-25 】【关注!】《药品管理法修订草案》二审强调重典治乱4月23日下午,十三届全国人大常委会第十次会议在北京人民大会堂闭幕。 会议对药品管理法修订草案和疫苗管理法草案进行了第二次审议。常委会组成人员指出,要坚持重典治乱,把“四个最严”写进法律,建立覆盖全过程全.. 来源
来源  705
705 -

【2019】
【12-25 】药品注册审评审批制度改革持续深化,利于进口药品和创新药品注册效率!国家药品监督管理局 国家卫生健康委员会关于优化药品注册审评审批有关事宜的公告(2018年第23号) 为贯彻落实《中共中央办公厅 国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅.. 来源
来源  709
709
友情链接:

关注官方微信

关注医械创新谷
Copyright © 2020 苏州苏州苏豪生物材料科技有限公司 版权所有 苏ICP备19075400号-1 互联网药品信息服务资格证编号: (苏)-非经营性-2020-0041


 苏公网安备 32050602011157号
苏公网安备 32050602011157号




